Un vaccin personnalisé contre la forme la plus agressive du cancer du sein
Une équipe de recherche du CRCHUS travaille sur le développement d’un vaccin personnalisé pour traiter le cancer du sein triple négatif, le sous-type le plus agressif et difficile à traiter. Découvrez comment cette initiative, soutenue par l’Oncopole et plusieurs autres organismes, pourrait améliorer de manière significative le pronostic des patientes.
———————————————
Dans le combat sans relâche contre le cancer, les équipes de recherche ne cessent de repousser les limites de l’innovation. Parmi ces pionniers et pionnières, la professeure Lee-Hwa Tai du Centre de recherche du CHUS (CRCHUS) se distingue par ses travaux novateurs sur un vaccin personnalisé contre le cancer du sein triple négatif (CSTN), l’une des formes les plus agressives et difficiles à traiter de cette maladie.

L’équipe de recherche de la Dre Lee-Hwa Tai
Un fléau à combattre : le cancer du sein triple négatif
« Le cancer du sein triple négatif touche environ 5 000 femmes canadiennes chaque année et présente un pronostic sombre. Les traitements traditionnels, tels que la chimiothérapie et les thérapies ciblées, s’avèrent souvent inefficaces contre ce type de cancer agressif » , explique Lee-Hwa Tai.
En effet, à ce jour, il n’existe pas de thérapie ciblée pour les femmes atteintes d’un cancer du sein triple négatif*.
Les mécanismes moléculaires et les voies biologiques sous-jacentes à ce type de cancer restent largement méconnus. Par conséquent, le développement de thérapies ciblées s’avère particulièrement difficile, car il n’existe pas de cibles moléculaires spécifiques à attaquer. Cette absence de cibles précises représente un défi majeur pour les chercheurs et chercheuses dans la conception de traitements efficaces contre le CSTN.
« Certaines patientes, diagnostiquées à un stade précoce et répondant aux traitements traditionnels, peuvent être guéries, mais la majorité des patientes voient leur maladie évoluer rapidement malgré les traitements », précise la professeure.
*Les cancers du sein dits « triple négatif » constituent un groupe de tumeurs caractérisées par l’absence de récepteurs hormonaux et de la protéine HER2 à la surface de leurs cellules (ER-, PR-, HER2-). Ils ne sont donc pas éligibles aux traitements ciblant ces trois types de marqueurs.
Une nouvelle approche prometteuse : le vaccin anticancéreux personnalisé
Face à ce défi persistant, l’équipe de recherche dirigée par la professeure Lee-Hwa Tai s’est engagée dans une démarche novatrice : le développement d’un vaccin personnalisé contre le CSTN. Cette approche innovante vise à exploiter le potentiel du système immunitaire pour combattre les cellules cancéreuses de manière ciblée et efficace.
Le concept d’un vaccin personnalisé repose sur une idée simple mais puissante : utiliser les propres cellules tumorales de la patiente pour stimuler son système immunitaire à reconnaître et à détruire les cellules cancéreuses. Contrairement aux traitements conventionnels qui agissent de manière non spécifique sur toutes les cellules, un vaccin personnalisé cible spécifiquement les cellules tumorales, minimisant ainsi les effets secondaires indésirables.
« En exploitant cette approche personnalisée, nous espérons surmonter les limitations des traitements conventionnels et offrir une nouvelle perspective aux patientes atteintes de cancer du sein triple négatif », déclare Lee Hwa Tai.
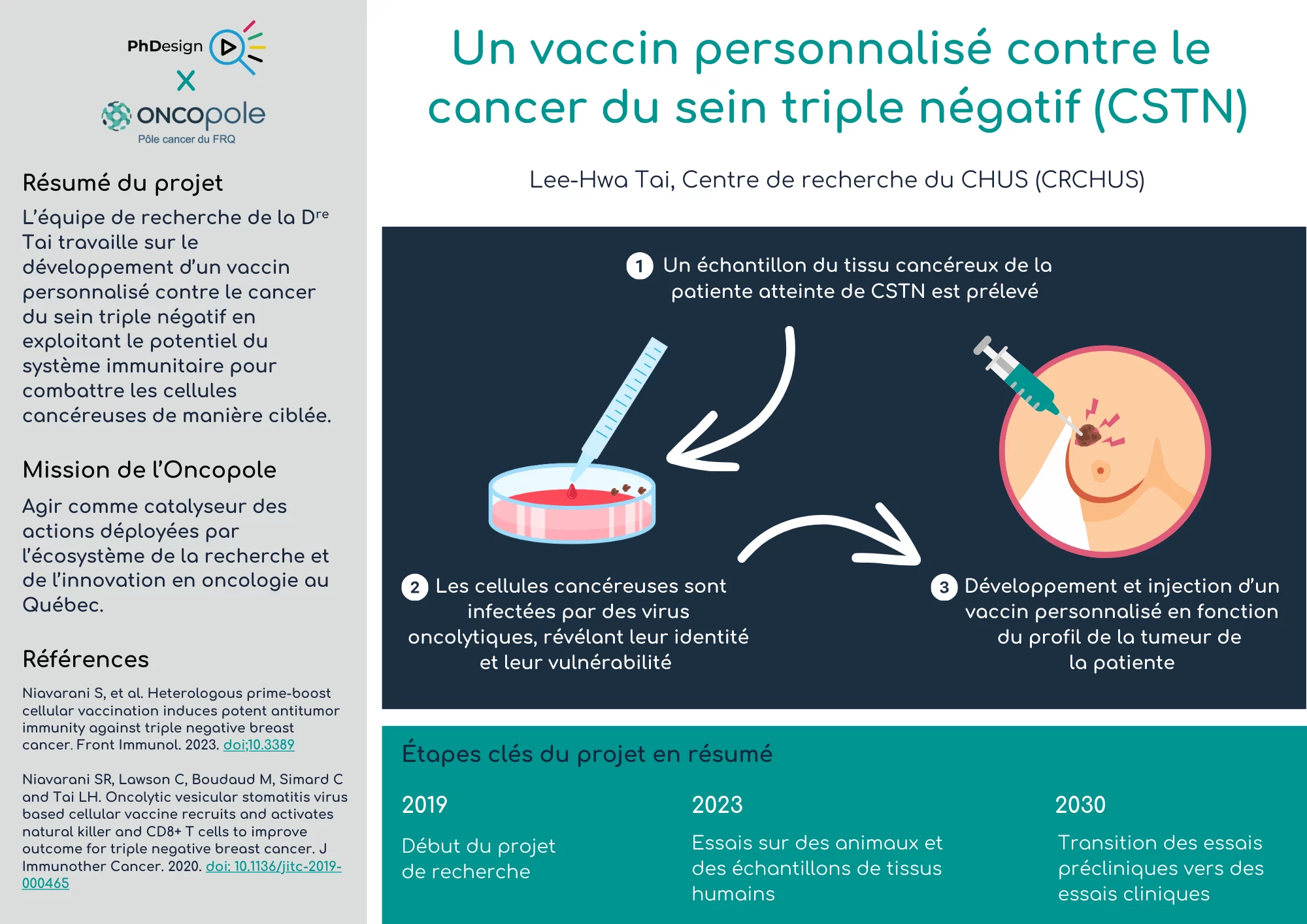
Révéler l’identité cachée du CSTN
Sachant que les caractéristiques spécifiques du CSTN demeurent largement méconnues et pour mieux appréhender la singularité de ce cancer, l’équipe de recherche a opté pour une méthode d’infection virale, permettant ainsi aux cellules cancéreuses de révéler leur identité propre.
Des virus, appelés virus oncolytiques, ont la capacité de pénétrer spécifiquement dans les cellules cancéreuses tout en laissant les cellules normales indemnes. Une fois à l’intérieur de la cellule cancéreuse, le virus se réplique et se propage, détruisant ainsi la cellule hôte.
Lorsque les cellules cancéreuses sont infectées par ces virus, elles subissent une série de changements moléculaires et cellulaires. Ces changements peuvent inclure des altérations dans l’expression des gènes, la production de protéines spécifiques et la libération de signaux moléculaires. En réponse à cette infection virale, les cellules cancéreuses activent leurs mécanismes de défense immunitaire et déclenchent des réponses inflammatoires.
Ces réponses immunitaires et inflammatoires induites par l’infection virale fournissent des informations précieuses sur les caractéristiques biologiques et immunologiques des cellules cancéreuses. Elles révèlent l’identité propre de ces cellules en mettant en lumière leurs signatures moléculaires uniques, leurs vulnérabilités et leurs interactions avec le système immunitaire de l’hôte.
En poursuivant cette approche, l’équipe cherche à créer une solution sur mesure, s’adaptant aux caractéristiques uniques de chaque patiente. Le processus de développement de ce vaccin implique donc la collecte de tissus tumoraux spécifiques à chaque patiente. Ces échantillons sont ensuite utilisés pour formuler un vaccin sur mesure, adapté au profil moléculaire unique de chaque tumeur.
« En d’autres termes, un vaccin propre à chaque patiente », explique la professeure.
Des résultats encourageants
Les résultats préliminaires obtenus chez des souris porteuses de tumeurs sont encourageants. Ils indiquent que le vaccin entraîne une amélioration de la survie, en particulier en renforçant la réponse immunitaire, notamment par l’activation des cellules T*. L’importance du régime d’administration du vaccin a également été mise en évidence, avec une stratégie primo-vaccination/rappel utilisant différentes formulations vaccinales qui s’est avérée plus efficace que des doses successives d’une même formule.
* Type de lymphocyte (globule blanc) qui aide à réguler la réaction immunitaire (réaction du système immunitaire en présence de substances étrangères dans le corps), à combattre les infections et à détruire les cellules anormales, y compris les cellules cancéreuses.
De plus, l’équipe de recherche a observé que la précocité de l’intervention chirurgicale pour prélever les cellules utilisées dans la formulation du vaccin joue un rôle crucial dans l’amélioration de la survie, surtout lorsqu’elle est associée à la stratégie primo-vaccination/rappel.
« Ces résultats, bien que préliminaires et obtenus sur des modèles animaux, mettent en lumière l’importance capitale de la détection et du traitement précoces du cancer du sein triple négatif. Ils ouvrent également la voie à de nouvelles perspectives prometteuses dans le développement de thérapies personnalisées et ciblées pour cette forme particulièrement agressive de cancer du sein », déclare Lee-Hwa Tai.
La suite
L’équipe de recherche se tourne désormais vers la prochaine étape indispensable : la transition des essais précliniques vers les essais cliniques.
« Nous espérons démarrer les essais cliniques d’ici 2030 », annonce la chercheuse.
L’objectif est de passer des expérimentations en laboratoire sur des modèles animaux à des essais impliquant des patientes. Ces essais cliniques visent à évaluer l’innocuité, la tolérabilité et l’efficacité du vaccin chez les patientes atteintes de CSTN.
« C’est une période excitante pour notre équipe, car chaque étape franchie nous rapproche de notre but ultime : offrir une nouvelle solution thérapeutique aux patientes. Les premiers résultats précliniques sont prometteurs, renforçant notre optimisme pour les futures phases de développement. Nous restons toutes et tous déterminés à surmonter les défis et à poursuivre nos efforts avec le même dévouement qui nous a menés jusqu’ici. Les prochaines années seront cruciales et promettent de grandes avancées pour la santé des patientes », conclut Lee-Hwa Tai.
Pour en savoir plus:
- Article de La Tribune
- Article du Fonds de recherche du Québec sur ce sujet
Rédigé par Feriel Slim, de l’ Agence PhDesign